青岛


近日,中国水产科学研究院黄海水产研究所海水养殖生物育种与可持续产出全国重点实验室邵长伟研究员团队通过创建工程化外泌体靶向递送功能分子(miRNA)至鱼体性腺,实现了对性别关键基因的精准调控。这是工程化外泌体在水产动物中的首次开发应用,将在水产动物基因功能精准调控及生殖干细胞靶向移植等领域发挥重要作用。研究成果以“Exosome Delivery to the Testes for dmrt1 Suppression: A Powerful Tool for Sex-Determining Gene Studies”为题发表于Journal of Controlled Release。
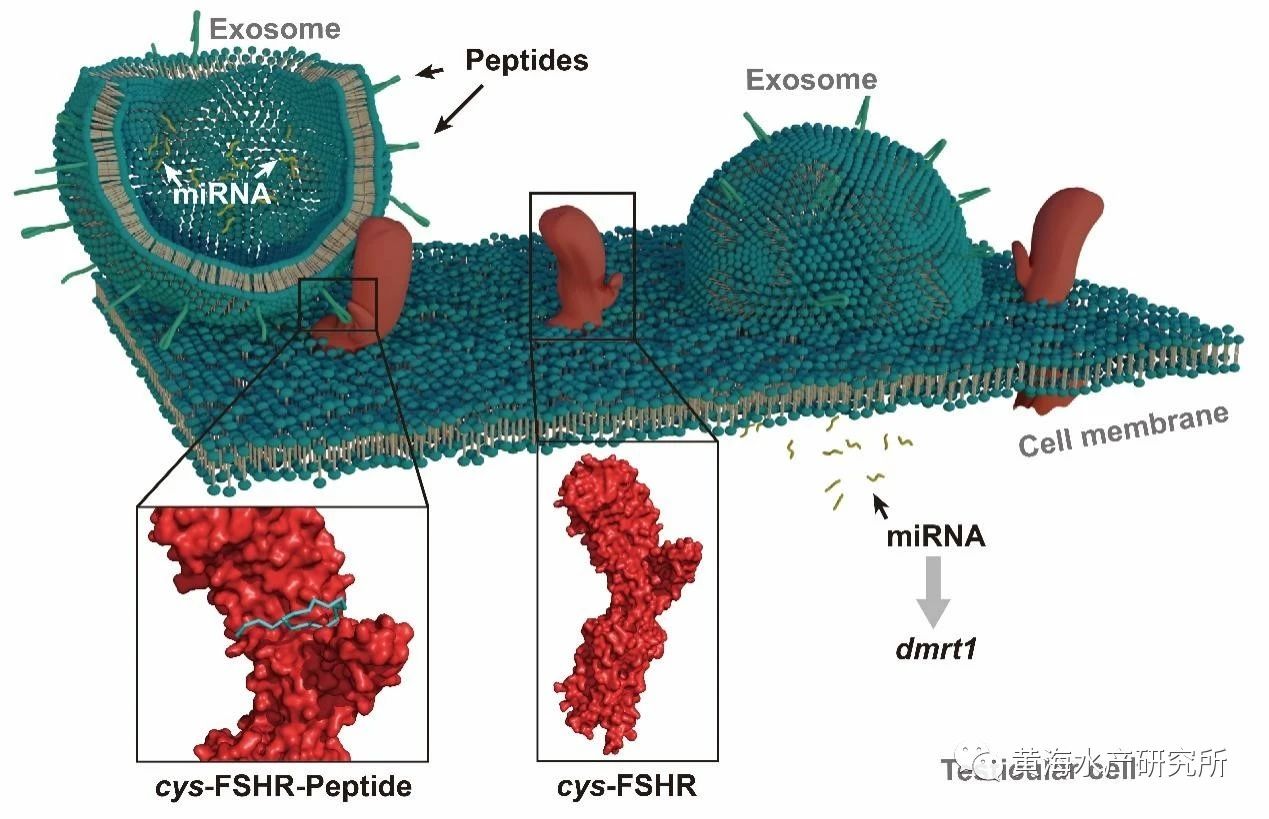
外泌体(Exosomes)是大多数细胞都能分泌的细胞外囊泡,直径约100纳米,因其具有免疫原性低、毒性低等优势,使其成为极具潜力的功能分子和药物递送载体,然而目前其应用仅局限于人类等哺乳动物医药研究领域。邵长伟研究员团队以半滑舌鳎为模型,以多种动物中较保守的性别关键基因dmrt1为调控对象,通过生物信息学与分子、细胞生物学实验方法,成功构建了工程化外泌体,实现了dmrt1调控分子向半滑舌鳎精巢细胞的靶向递送(图1)。
图1.工程化外泌体靶向递送dmrt1调控分子
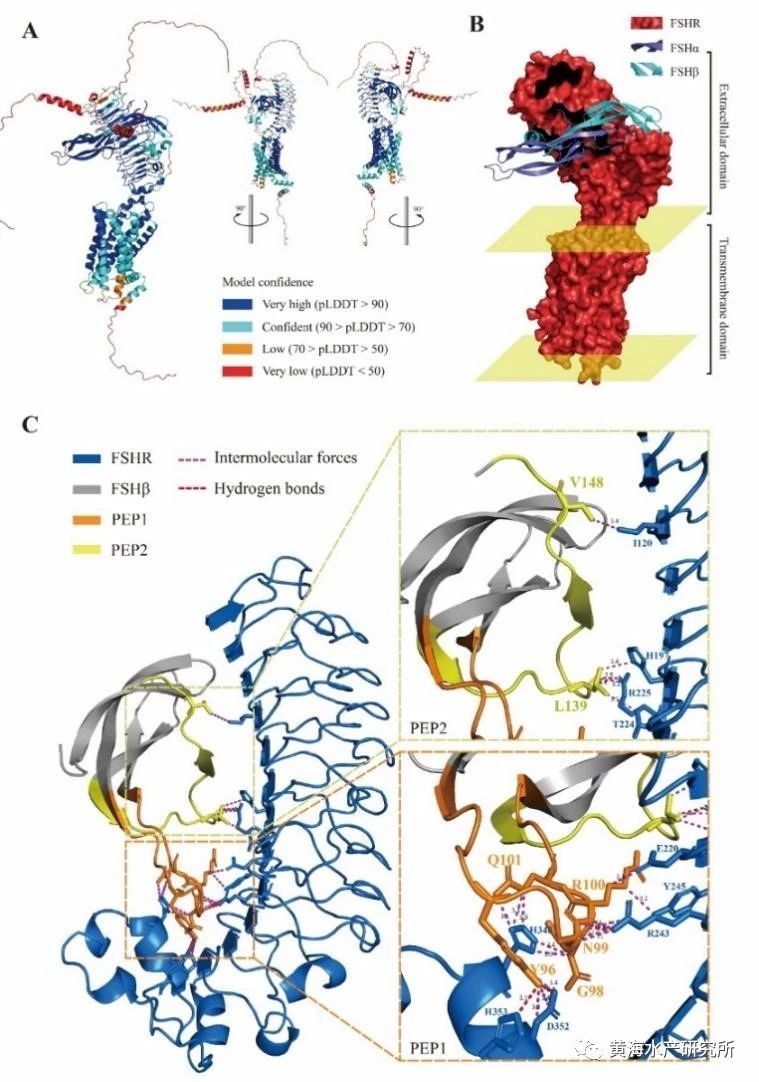
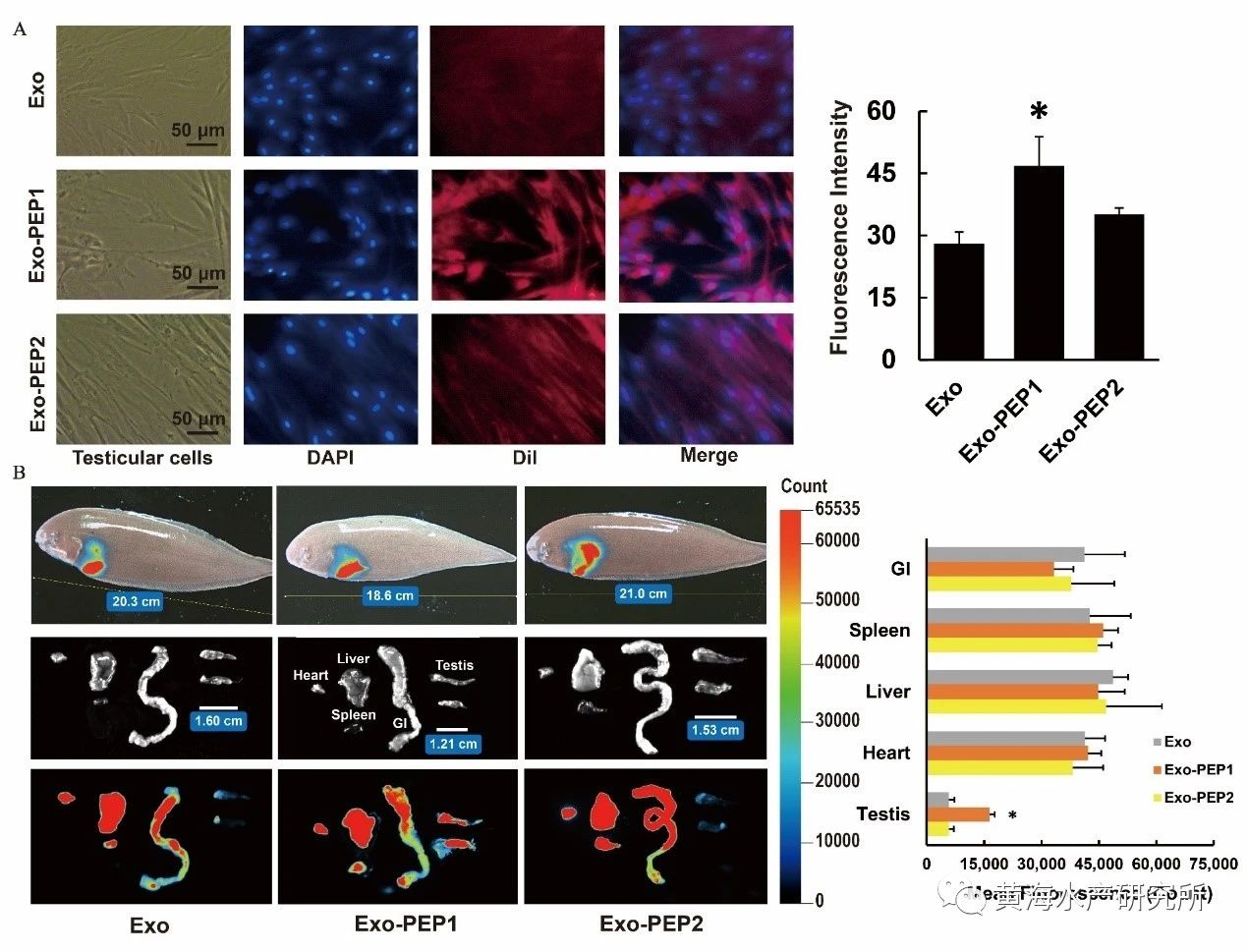
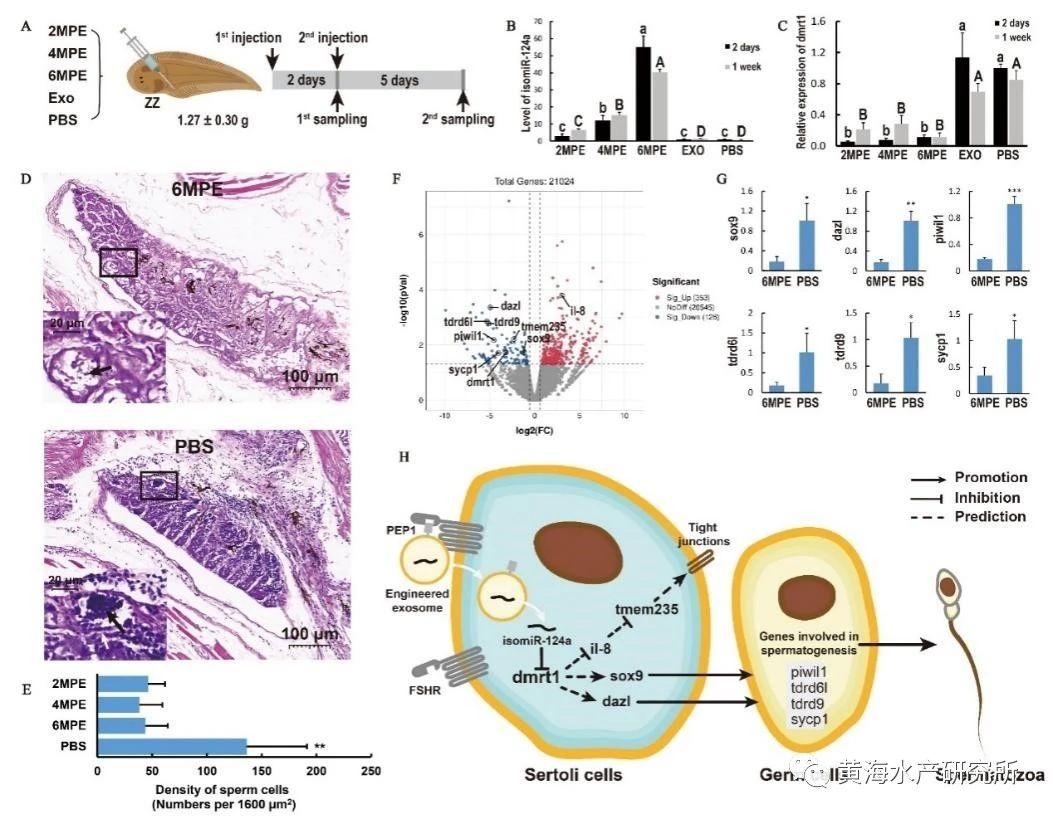
该工程化外泌体构建技术体系主要包括内含物的筛选、靶向肽的确定以及工程化外泌体的制备三部分。内含物的筛选是指通过TargetScan和miRanda预测以及双荧光素酶、性腺细胞培养等实验,筛选出能够有效抑制dmrt1性别决定基因表达的miRNA。靶向肽的确定首先要通过半滑舌鳎精巢单细胞测序、全转录组测序等技术筛选出精巢Sertoli细胞膜高表达的受体FSHR,再通过Alphafold建立FSHR受体及其天然配体FSH的三维复合物结构,最终获取结合域候选关键肽段(图2)。工程化外泌体的制备则首先要通过差速超速离心方法提取卵巢细胞外泌体,并使用磷脂膜锚定技术将候选肽段加载到外泌体膜表面,再通过细胞和活体实验分别验证获得高效靶向半滑舌鳎精巢的工程化外泌体(图3)。最后通过活体注射方式,将该工程化外泌体应用于活体靶向抑制半滑舌鳎精巢dmrt1的表达,证实了dmrt1在维持精巢形态结构和促进精子发生过程中起到重要作用(图4)。该技术体系的建立不仅实现了对性别相关基因功能的精准调控,还应用到了鱼类生殖干细胞的靶向移植研究中,有望大幅提高生殖干细胞的移植效率,展示出了较强的应用潜力。
本研究是在该团队首次证实鱼类性别决定与分化的ceRNA调控机制、鱼类性别发生的细胞学基础等工作之后(Genome Research, 2022;Science China Life Sciences, 2022),在鱼类性别决定与分化表观遗传领域取得的又一重要标志性成果。
图2.FSHR受体及其配基复合物结构
图3.细胞和活体实验证实PEP1修饰的外泌体具有更强的精巢靶向性
图4.应用工程化外泌体实现半滑舌鳎精巢dmrt1的靶向抑制
https://www.sciencedirect.com/science/article/abs/pii/S0168365923006144?via%3Dihub
本文来源:中国水产科学研究院黄海水产研究所