青岛


近日,中国科学院水生生物研究所徐镇团队等进一步揭示了鱼类黏膜免疫与微生物的稳态调控机制,该研究成果以“Ocular mucosal homeostasis of teleost fish provides the coevolution insight into microbiome and mucosal immunity”为题在线发表于Microbiome,该研究为脊椎动物黏膜免疫与微生物协同塑造提供新见解。
鱼类生存环境特殊,黏膜不仅作为物理屏障隔离身体与复杂的外界环境,同时演化出了集先天性和适应性免疫的独特黏膜免疫系统,以保护硬骨鱼类有效应对来自水环境中病原体的“威胁和挑战”。鱼类黏膜表面存在复杂且动态的共生微生物群,参与了鱼体营养、代谢、免疫等一系列生命过程。事实上,免疫系统和共生微生物在数百万年的进化过程中相互依存,彼此塑造。微生物群在训练宿主免疫系统方面起着关键作用,反过来免疫系统调节和塑造黏膜表面微生物群。然而目前,鱼类黏膜免疫与共生微生物的相互作用研究仍有待进一步解析。
中国科学院水生生物研究所徐镇研究员团队长期从事鱼类黏膜在抵抗病原感染以及与共生微生物免疫互作的研究。正常的微生物群有助于鱼类健康,微生物群落的紊乱可能导致黏膜免疫功能失调,产生继发性感染和疾病 (Yu, 2021)。该实验室前期以虹鳟为模型,解析了黏膜免疫(免疫球蛋白)在维持宿主黏膜共生微生物稳态中发挥重要功能 (Xu, 2020; Kong, 2022)。
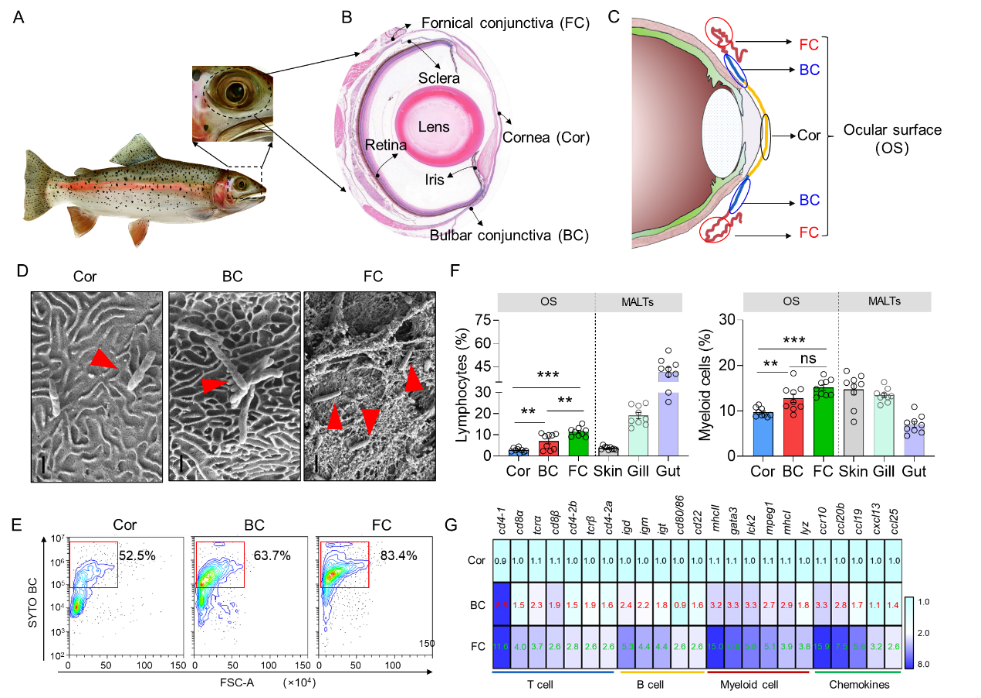
该研究以鱼类眼黏膜(Ocular mucosa, OM)为研究模型,详细刻画了鱼类眼黏膜的基本结构,进一步发现稳定状态下共生微生物含量与黏膜免疫水平高度相关(图1),暗示微生物与黏膜免疫之间可能存在潜在的相互调控作用。
图1:硬骨鱼类眼黏膜的结构与特征
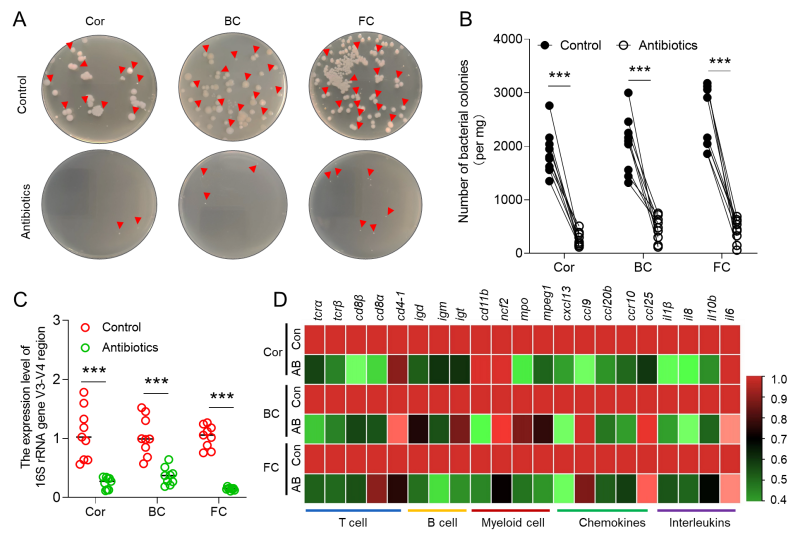
为了进一步评估黏膜表面的微生物群是否有助于其免疫环境的形成,通过抗生素消除微生物后,与免疫相关的基因表达水平显著降低(图2),这表明黏膜处微生物参与塑造局部免疫微环境。
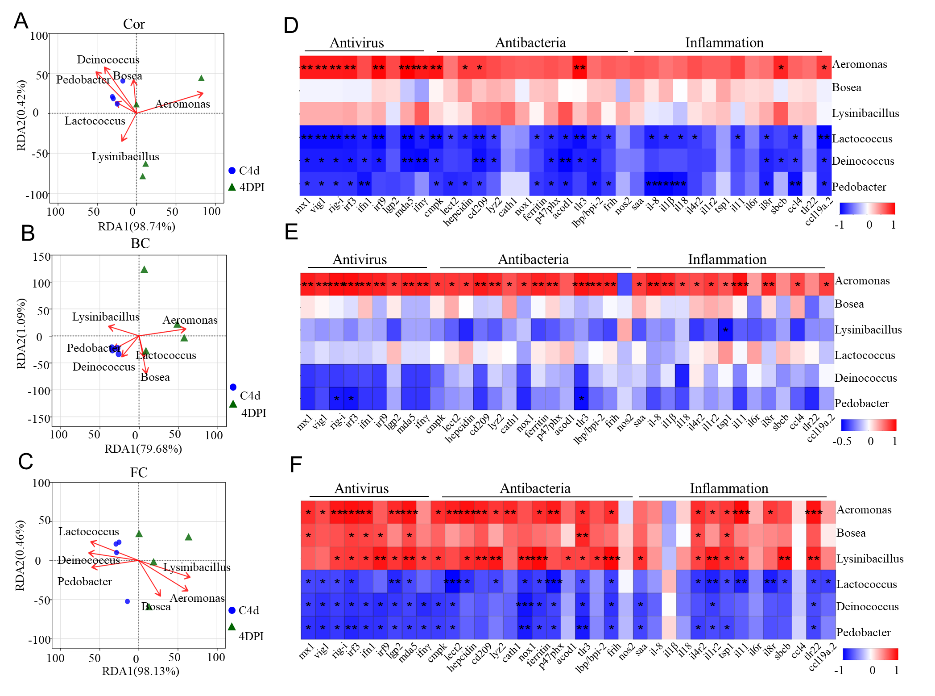
重要的是,在病毒感染后,黏膜变化的微生物群和免疫相关基因表达显著相关(图3)。暗示病原菌很大程度上促进抗菌和炎症基因的表达,而有益细菌则起相反的作用。此外,伴随着后期组织损伤和微生物移位的逆转,以及微生物群稳态的恢复,炎症反应也随之消失。以上结果表明硬骨鱼类黏膜免疫与微生物之间相互塑造,共同维持宿主的黏膜稳态平衡。
图3:微生物群与免疫相关基因之间的相关性分析
该研究进一步丰富了人们对黏膜免疫与共生微生物群之间稳态调控机制的认知。中国科学院水生生物研究所为第一完成单位,徐镇研究员为论文通讯作者,中国科学院水生生物研究所助理研究员孔维光,华中农业大学博士生程高锋和曹佳烽(现任宁波大学助理研究员)为论文共同第一作者。该研究受到国家自然科学基金、国家重点研发计划和中国博士后科学基金等项目的支持。
参考文献:
Kong, W., Cheng, G., Cao, J., Yu, J., Wang, X., & Xu, Z. (2024). Ocular mucosal homeostasis of teleost fish provides insight into the coevolution between microbiome and mucosal immunity. Microbiome, 12(1), 10.
Yu, Y, Ding, L., Huang, Z, Xu, H., & Xu, Z. (2021). Commensal bacteria‐immunity crosstalk shapes mucosal homeostasis in teleost fish. Reviews in Aquaculture, 13(4), 2322-2343.
孔维光, 曹佳烽, 程高锋, 于永耀, 徐镇. 硬骨鱼类黏膜B细胞和免疫球蛋白研究进展. (2023). 科学通报, 68(15): 1869-1883.
https://microbiomejournal.biomedcentral.com/articles/10.1186/s40168-023-01716-6
本文来源:中国科学院水生生物研究所